1. はじめに
医薬品業界に大きな波紋を広げている問題があります。
それは米国連邦取引委員会(FTC)が、「オレンジブック」(Orange Book)と呼ばれる医薬品承認情報データベースの特許リストに対して、かつてない厳しい姿勢で取り締まりを行っていることです。この動きは、アメリカにおける製薬会社の特許戦略、ジェネリック医薬品の市場参入、そして最終的には患者の医薬品へのアクセスに至るまで、広範な影響を及ぼす可能性があります。
FTCは、一部の製薬会社が不適切な特許をオレンジブックにリストすることで、ジェネリック医薬品の参入を不当に遅らせ、結果として薬価を高止まりさせているのではないかと懸念しています。そしてこの問題は同時に、イノベーションの保護と公正な競争のバランスをどう取るべきかという、製薬業界の根本的な課題に光を当てています。
本稿では、オレンジブックの役割から始まり、FTCの最近の行動、製薬会社の対応、そして今後予想される展開まで、この複雑な問題の全体像を詳しく解説します。医療関係者、製薬業界の専門家、そして医薬品政策に関心を持つ方々にとって、重要な情報源となるでしょう。
2. オレンジブックと特許リストの背景
2.1. オレンジブックの定義と目的
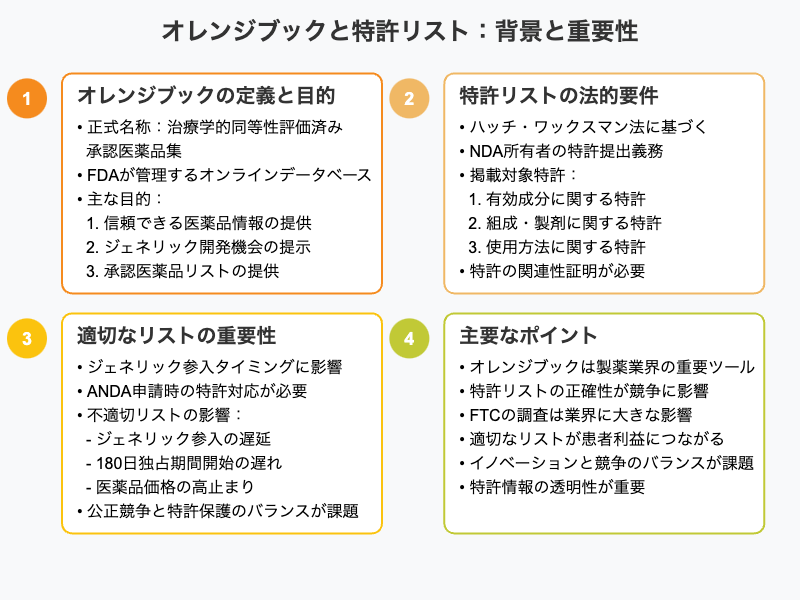
「オレンジブック」(Orange Book)は、正式名称を「Approved Drug Products with Therapeutic Equivalence Evaluations(治療学的同等性評価済み承認医薬品集)」といい、その愛称は最初に発行された際の表紙の色に由来します。1980年のハロウィーンに初めて発行されたこの資料は、現在ではオンラインデータベースとして運用されています。
オレンジブックは、単なる医薬品リストではありません。それは、製薬業界の競争と革新のバランスを取るための重要なツールです。米国食品医薬品局(Food and Drug Administration、FDA)が管理するこのデータベースには、承認された医薬品の詳細情報が掲載されています。具体的には、ブランド名、一般名、製造元、用量形態、そして何より重要な 特許情報 が含まれています。
オレンジブックの主な目的は三つあります:
- 医療専門家や患者に信頼できる医薬品情報を提供すること
- ジェネリック医薬品メーカーに新製品開発の機会を示すこと
- FDAが安全性と有効性を認めた医薬品のリストを提供すること
特に2番目の目的が、今回のFTCの動きと密接に関連しています。ジェネリック医薬品メーカーは、オレンジブックの特許情報を確認することで、いつジェネリック版の開発に着手できるかを判断できるのです。そのためオレンジブックの特許情報の正確性は、ジェネリック医薬品の市場参入に大きな影響を与えます。
2.2. 特許リストの法的要件
今回注目する特許リストに関する法的要件は、ハッチ・ワックスマン法に遡ります。ハッチ・ワックスマン法(Hatch-Waxman Act)は、1984年に成立した米国の連邦法で、正式名称は「薬剤価格競争および特許期間回復法」(Drug Price Competition and Patent Term Restoration Act)です。この法律の目的は、ジェネリック医薬品の市場参入を促進しながら、革新的な製薬会社の研究開発投資を保護することです。
この法律により、新薬承認申請(New Drug Application、NDA)の所有者は、その医薬品に関連する特許をFDAに提出し、オレンジブックに掲載することが義務付けられました。
具体的には、以下の特許が掲載対象となります:
- 医薬品の有効成分に関する特許
- 医薬品の組成や製剤に関する特許
- 医薬品の使用方法(適応症など)に関する特許
ただし、ここで重要なのは、全ての特許が自動的にリストされるわけではないということです。また、NDA所有者には、リストする特許が実際に医薬品をカバーしているという証明責任があります。これが、今回のFTCの調査の焦点となっている部分です。
2.3. 適切なリストの重要性
では適切な特許リストがなぜそれほど重要なのでしょうか?
その理由はオレンジブックの目的でも少し触れましたが、このリストがジェネリック医薬品の市場参入のタイミングを左右するからです。
ジェネリック医薬品メーカーが略式新薬承認申請(Abbreviated New Drug Application、ANDA)を提出する際、オレンジブックに掲載された各特許について、その有効性を争うか、特許の有効期限まで待つかを宣言しなければなりません。そのため、不適切に掲載された特許があれば、ジェネリック医薬品の市場参入が不当に遅れる可能性があります。
さらに、最初にANDAを提出し、特許の有効性を争ったジェネリックメーカーには、180日間の市場独占期間が与えられます。この制度は、ジェネリックメーカーに特許挑戦のインセンティブを与える一方で、不適切な特許リストがあれば、この独占期間の開始も遅れることになります。
結果として、不適切な特許リストは、医薬品価格の高止まりにつながる可能性があります。FTCが今回の取り組みを重視している理由は、まさにここにあるのです。
このように、オレンジブックは製薬業界において極めて重要な役割を果たしています。それゆえに、FTCによる今回の取り組みは業界に大きな影響を与える可能性があるのです。適切な特許リストは、公正な競争を促進し、最終的には患者の利益につながります。しかし、その一方で、イノベーションを促進するための特許保護とのバランスも考慮しなければなりません。この微妙なバランスを取ることが、現在の製薬業界における大きな課題となっているのです。
3. FTCの特許リストに対する取り締まりの経緯

3.1 2023年9月の政策声明
FTCの新たな取り締まり方針は、2023年9月の政策声明を皮切りに始まりました。この声明の核心は、「不適切なオレンジブック特許リストは不公正な競争方法を構成する可能性がある」というものです。FTCは、こうしたリストが連邦取引委員会法第5条に違反する可能性があると明確に示したのです。
また不適切なリストに対する潜在的なリスクは、反トラスト法違反での訴訟にとどまらず、合併審査への影響、個人の法的責任追及、さらには刑事捜査の可能性まで多岐にわたります。これらの厳しい措置は、製薬企業に特許リストの正確性と適切性について慎重な検討を促すものとなりました。
3.2. 2023年11月の初期の取り締まり
この声明から間もない2023年11月、FTCは製薬業界に対して初めての大規模な特許リストへの取り締まりを行いました。
FTCは10社の大手製薬会社に対し、100以上の特許リストに疑問を呈する書簡を送付しました。主な対象は、喘息吸入器と自己注射用エピネフリン製剤に関連する特許でした。FTCの主張によれば、これらの 特許の多くは医薬品自体ではなく、投与デバイスに関するものであり、オレンジブックへの掲載は不適切 だというのです。
3.3. 2024年4月の拡大された取り締まり
FTCの取り締まりは、2024年4月に入ってさらに拡大しました。今回は、前回を大きく上回る規模で特許リストへの取り締まりが行われたのです。
4月30日、FTCは新たに10社の製薬会社に対して書簡を送付しました。今回の対象は、実に300以上の特許リストに及びました。挑戦の範囲も拡大され、糖尿病、肥満、喘息、慢性閉塞性肺疾患(COPD)、重度の低血糖症の治療に使用される20種類のブランド医薬品が含まれていました。
特に注目を集めたのは、オゼンピックやビクトーザなどの人気糖尿病・肥満治療薬に関連する特許でした。これらの医薬品は、近年急速に市場を拡大しており、FTCの動きは大きな反響を呼びました。
3.4. 挑戦された特許の具体例
FTCが挑戦した特許の中には、興味深い事例がいくつか含まれています。これらの例を見ることで、FTCの主張がより具体的に理解できるでしょう。
1つ目の例は、ノボ・ノルディスク社の特許US7,654,986です。この特許は、注射デバイスの針装着システムに関するものです。1つの見方によっては、この特許は糖尿病治療薬の投与に重要かもしれません。しかし、FTCの見解では、薬剤そのものではなくデバイスに関する特許であるため、オレンジブックへの掲載は不適切だと主張しています。
2つ目の例として、グラクソ・スミスクライン社の特許US8,161,968が挙げられます。この特許は、複数の薬剤キャリアを含む医薬品ディスペンサーに関するものです。FTCは、この特許も薬剤自体ではなく、その 投与方法に関するものだとして疑問 を呈しています。
最後に、ノバルティス社の特許US8,182,838を見てみましょう。この特許は、乾燥粉末吸入器に含まれる製剤に関するものです。一見すると薬剤に直接関連しているように見えますが、FTCは、この特許が薬剤そのものではなく、その 投与形態に焦点を当てている と主張しています。
これらの例から、FTCが主に問題視しているのは、医薬品そのものではなく、その投与方法やデバイスに関する特許だということがわかります。FTCの見解では、こうした特許はオレンジブックに掲載すべきではなく、掲載することでジェネリック医薬品の参入を不当に遅らせているというわけです。
この問題は、医薬品の革新と競争のバランスをどう取るべきかという、より大きな議論につながっています。今後、この議論がどのように展開していくか、業界関係者の注目が集まっています。
4. 製薬会社の対応
4.1. 特許を取り下げした企業
FTCの挑戦に対し、一部の製薬会社は迅速に行動を起こしました。2023年11月の1回目の取り締まりを受けて、4社が指摘された特許の大部分または全てを取り下げすることを選択したのです。
例えば、ある大手製薬会社は、喘息治療薬に関連する5つの特許をオレンジブックから削除しました。また別の企業は、自己注射器に関する3つの特許を取り下げました。
これらの企業は、FTCの指摘に対して迅速かつ積極的に対応し、患者の利益と競争促進の重要性を考慮した行動を取ることで、業界内外から注目を集めました。この姿勢は規制当局との協調的なアプローチを示すとともに、法的リスクの回避と企業イメージの向上を同時に達成する戦略的な判断だったと評価されています。
4.2. リストを維持している企業
その一方で、多くの企業はFTCの要求に応じず、特許リストを維持する姿勢を示しています。彼らの主張は、自社の特許が法的要件を満たしており、オレンジブックへの掲載は正当だというものです。
テバ・ファーマシューティカル社は、その代表例と言えるでしょう。同社は2024年1月8日、議員たちに宛てた書簡の中で次のように述べています。「テバは決して特許リストを競争抑制や独占延長、患者への価格吊り上げのために利用したことはありません。むしろ、強固な特許リストは競争を促進すると信じています。」
また、一部の製薬会社は、特許が長年の研究開発の成果であることを強調しており、これらの特許を取り下げるすることは、イノベーションへの投資を軽視することにつながりかねないという懸念が業界内で広がっています。
こうした企業の姿勢は、特許保護とイノベーション促進の重要性を強調するものです。そのため多くの製薬会社は、FTCの要求に簡単に屈することなく、法的な戦いも辞さない構えを見せています。
4.3. 取り下げの賛成論と反対論
特許の取り下げを巡っては、賛成派と反対派の間で熱い議論が交わされています。
取り下げ賛成派の主な論点は以下の通りです:
- 競争促進:不適切な特許リストを削除することで、ジェネリック医薬品の市場参入が加速し、結果として医薬品価格の低下につながる。
- 法令遵守:FTCの指摘に従うことで、将来的な法的リスクを回避できる。
- 透明性向上:真に革新的な特許のみをリストすることで、オレンジブックの信頼性が高まる。
一方、反対派の主張は次のようなものです:
- イノベーション抑制:特許保護の範囲が狭まることで、新薬開発への投資意欲が減退する恐れがある。
- 法的不確実性:FTCの判断基準が不明確であり、全ての特許を一律に取り下げすることは適切ではない。
- 患者への影響:特許保護が弱まることで、長期的には新たな治療法の開発が遅れ、患者が不利益を被る可能性がある。
結局のところ、この問題の解決には、全てのステークホルダーの利益を慎重に考慮した、バランスの取れたアプローチが必要になるでしょう。製薬会社、規制当局、そして最終的には患者の利益を最大化する方法を見出すことが、今後の大きな課題となっています。
5. 法的および規制面の展開
5.1. オレンジブックリストに関する最近の法的展開
FTCは、オレンジブック特許リストに関する訴訟において積極的な姿勢を見せています。その一環として、2024年3月にニュージャージー地方裁判所で行われたTeva v. Amneal訴訟に法廷助言者意見書(Amicus Brief)を提出しました。この意見書でFTCは、ハッチ・ワックスマン法における「薬剤製品」の定義を狭く解釈すべきだと主張し、デバイスやその構成要素に関する特許はオレンジブックにリストすべきでないとの見解を示しました。
この主張は、後の6月10日に下された判決に大きな影響を与えました。スタンリー・チェスラー判事は、Tevaに対し、FDAのオレンジブックに不適切にリストされていると判断された5つの喘息吸入器特許を修正または削除するよう命じました。
判決の核心は、問題の特許が「薬剤を主張していない」という点にありました。裁判所は、これらの特許が「計量吸入器デバイスの構成要素に向けられているが、アルブテロール硫酸塩やProAir® HFAについては主張も言及もしていない」と指摘し、「特許は、発明として特に指摘された主題のみを主張し、それ以上のものは主張しない」という原則に基づいて判断を下しました。
この判決はFTCの立場を強く支持するものであり、今後の類似案件に大きな影響を与えると予想されています。製薬業界は、この新たな法的解釈に基づいて、オレンジブックへの特許リストの戦略を再考する必要に迫られています。
5.2. FDAの役割と今後のガイダンス更新
FTCと共に、今回のオレンジブック特許リストの問題に関して重要な役割を果たしているのが米国食品医薬品局(Food and Drug Administration、FDA)です。FDAはFTCとの連携を強化しつつ、独自の立場からも行動を起こしています。
例えば、2022年、FDAは特許リストに関する多分野横断的なワーキンググループを設立しました。このグループの目的は、現行の法的要件の下で、オレンジブックに含めるべき、あるいは除外すべき特許の種類について、さらなる明確化が必要かどうかを評価することです。
さらに、2024年1月、FDAはオレンジブックへの特許情報提出に関するガイダンスを2024年中に更新する意向を表明しました。この新しいガイダンスは、2020年以来初めての大幅な更新となる見込みです。
このFDAの動きは、FTCの取り組みと相まって、オレンジブック特許リストの在り方を大きく変える可能性があります。今後のガイダンス更新の内容が、製薬業界の未来を左右する重要な転換点となるかもしれません。業界関係者は、この動向を注視し、迅速かつ適切に対応する準備を整えておく必要があるでしょう。
6. ジェネリック競争と薬価への影響
6.1. 不適切なリスト削除の潜在的利点
不適切な特許リストの削除は、医薬品市場に大きな変革をもたらす可能性を秘めています。その潜在的な利点は、患者から製薬会社まで、幅広いステークホルダーに及ぶでしょう。
まず、最も直接的な影響として、ジェネリック医薬品の市場参入が加速することが挙げられます。不必要な特許障壁が取り除かれることで、ジェネリックメーカーは製品開発と承認申請のプロセスをより迅速に進めることができるようになります。
これは単に時間の問題だけではありません。訴訟リスクの軽減にもつながります。現状では、多くのジェネリックメーカーが、オレンジブックに掲載された特許の有効性を争うために膨大な法的コストを負担しています。不適切なリストが削除されれば、これらのコストを大幅に削減できる可能性があります。
さらに、長期的には医薬品価格の低下につながることが期待されます。FDAの調査によれば、1つのブランド薬に対して少なくとも1つのジェネリック医薬品が市場に参入すると、価格が平均で約40%下がるとのことです。複数のジェネリック医薬品が競争すれば、価格はさらに下がる傾向にあります。
しかし、これらの利点には注意点もあります。イノベーションへの影響を懸念する声もあります。ある製薬業界のアナリストは次のように指摘しています。「確かに、短期的には価格低下の恩恵があるでしょう。しかし、特許保護が弱まることで、新薬開発への投資意欲が減退する可能性もあります。長期的な影響を慎重に見極める必要があります。」
6.2. ジェネリック競争促進に向けたFTCの目標
FTCの取り組みの根底には、ジェネリック競争を促進するという明確な目標があります。この目標は、単に医薬品価格を引き下げるだけでなく、より広範な影響を市場にもたらすことを狙っています。
FTC委員長のリナ・カーン氏は、ある講演でこう述べています。「我々の目標は、公正で活気のある医薬品市場を作ることです。不当な障壁を取り除き、真のイノベーションに基づく競争を促進したいのです。」
具体的には、FTCは以下のような成果を目指しています:
- ジェネリック医薬品の市場参入にかかる時間の短縮
- ジェネリックメーカーの開発コスト削減
- 医薬品選択肢の拡大
- 最終的な医薬品価格の低下
これらの目標を達成するため、FTCは特許リストの問題に加え、いわゆる「ペイ・フォー・ディレイ」取引(Pay-for-Delay agreements)の取り締まりや、製品ホッピング(特許切れが近づいた時に、わずかな改良を加えた新製品を発売し、特許保護を延長する戦略)への監視強化など、多角的なアプローチを取っています。
6.3. FTCの他の製薬業界イニシアチブとの関連性
オレンジブック特許リストへの挑戦は、FTCの包括的な製薬業界改革の一部に過ぎません。この取り組みは、他の重要なイニシアチブと密接に関連しています。
例えば、FTCは最近、大手製薬会社の合併案2件に異議を唱えました。これらの合併が、市場の集中度を高め、イノベーションを阻害する可能性があると判断したためです。この動きは、特許リスト問題と同様、競争促進と価格引き下げを目指すものです。
また、FTCは薬局給付管理会社(Pharmacy Benefit Manager、PBM)の調査も進めています。PBMは製薬会社と保険会社の間に立つ「仲介者」として、薬価設定に大きな影響力を持っています。FTCは、PBMの事業慣行が競争を歪め、最終的に患者の負担を増やしているのではないかと疑問を呈しています。
これらのイニシアチブは、互いに補完し合う関係にあります。特許リストの適正化、企業の過度な集中の防止、中間業者の役割の精査—これらが相まって、より健全で競争的な製薬市場の実現を目指しているのです。
FTCの包括的なアプローチは、製薬業界に大きな変革をもたらす可能性を秘めています。今後、これらの取り組みがどのような成果を上げ、市場と患者にどのような影響を与えるか、注視していく必要があるでしょう。
7. FTCのアプローチに対する批判と課題
7.1. 明確なFDAガイダンスの不足
このようなFTCの積極的な姿勢に対し、業界からは不満の声も出ています。その中でも 最も多く聞かれる批判の一つが、FDAによる明確なガイダンスの不足 です。2020年以来、FDAはオレンジブックの特許リストに関する具体的な指針を更新していません。この状況下で、FTCが突如として厳しい姿勢を示したことに、多くの製薬会社が戸惑いを隠せずにいます。
このことを受け、FDAは2024年中にガイダンスを更新する意向を示していますが、それまでの間、企業はどのように行動すべきなのでしょうか。この不確実性が、業界全体に不安と混乱をもたらしています。
7.2. 適切なリストの定義を巡る議論
「適切な特許リスト」とは何か。この一見シンプルな問いが、実は非常に複雑な議論を引き起こしています。
FTCは、医薬品そのものに直接関連する特許のみをリストすべきだと主張しています。しかし、現代の医薬品開発において、投与デバイスや製剤技術は不可欠な要素です。これらの特許を除外することは、イノベーションの価値を過小評価することにつながるのではないか、という懸念の声が上がっています。
このような懸念がある一方で、ジェネリックメーカーの立場からは、「デバイス特許の過度な保護が、不必要に市場参入を遅らせている」という主張もあります。
この議論は、単なる法的解釈の問題を超えて、医薬品のイノベーションとは何か、どこまでを保護すべきかという根本的な問いに発展しています。簡単に結論が出せる問題ではありませんが、業界全体でのオープンな対話が必要とされています。
7.3. FTCの権限とアプローチに関する疑問
また、FTCの積極的なアプローチに対し、「果たしてこれはFTCの権限の範囲内なのか」という疑問の声も上がっています。
従来、医薬品の規制はFDAの専管事項とされてきました。FTCが特許リストの適切性に介入することは、権限の逸脱ではないかという指摘があるのです。
また、FTCのアプローチが対話よりも対立を重視しているように見えるという懸念が業界内で広がっています。FTCには、より建設的な姿勢で業界との協議を行うべきだという声が上がっており、現在の手法の妥当性に疑問が投げかけられています。
さらに、FTCの行動が長期的にどのような影響を及ぼすかについても懸念の声があります。短期的な価格引き下げは実現できるかもしれませんが、製薬会社の研究開発意欲を削ぐことになれば、結果的に新薬の開発が遅れ、患者が不利益を被る可能性もあるのです。
これらの批判や課題に対し、FTCはどのように応えていくのでしょうか。また、製薬業界はこの新しい規制環境にどのように適応していくのか。今後の展開が注目されます。
8. 今後の展望

8.1. さらなるFTC執行措置の可能性
FTCの動きは、今後さらに加速する可能性が高いでしょう。これまでの警告的なアプローチから、より直接的な執行措置へと移行する兆しが見えています。
そこには、FTCが特許リストの問題を単なる行政指導で終わらせるつもりはないという見方が広がっています背景があります。近い将来、FTCが象徴的な大型訴訟を起こす可能性が高いと予測されており、そうした行動を通じて業界全体に強いメッセージを送ろうとしているのではないかという観測も一部で出てきています。
特に注目されているのが、糖尿病薬や肥満治療薬の分野です。これらの薬剤は近年急速に市場を拡大しており、多くの特許が絡んでいます。FTCが、この分野での「不適切な」特許リストを標的にする可能性は十分にあります。
また、FTCは個別の特許リスト以外にも、企業の過去の行動パターンにも注目しているようです。繰り返し「不適切な」リストを行っている企業に対しては、より厳しい措置が取られる可能性があります。
8.2. 予想されるFDAガイダンス
FDAが2024年中に発表を予定している新ガイダンスは、業界に大きな影響を与えるでしょう。多くの専門家が、このガイダンスがオレンジブック特許リストの「グレーゾーン」を明確にすると期待しています。
ガイダンスで特に注目されているのは、以下の点です:
- 「薬剤製品」の定義の明確化
- デバイス特許のリスト基準
- 製剤特許の取り扱い
- リスト後の定期的な見直しプロセス
FDAの新ガイダンスは、FTCの立場により近いものになる可能性が高いと見られています。ただし、イノベーション促進のための一定の柔軟性は残されるだろうという予測もあります。このガイダンスの発表を受けて、多くの製薬会社が自社の特許戦略を大幅に見直す必要に迫られるのではないかという見方が広がっています。
8.3. 考えられる議会の行動
議会も、この問題に無関心ではいられません。
2024年5月の上院公聴会では、デバイス特許のリストに関する懸念が表明されました。また、議会調査局は、オレンジブック特許リストと30ヶ月自動停止条項を「注目すべきトピック」として挙げています。
議員たちの間では、法改正の必要性を訴える声も上がっています。現行法におけるFTCやFDAの権限の不明確さが指摘されており、より明確な基準設定と適切な監督メカニズムの確立を求める声が上がっています。一方で、過度の規制がイノベーションを阻害する可能性を懸念する意見も出ています。このような異なる立場の間で妥協点を探りながら、何らかの法案が提出される可能性が高まっています。
法案が実際に可決されるかどうかは不透明ですが、議会の動きだけでも、業界に大きな影響を与えるでしょう。製薬会社は、これらの政治的な動向も注視しながら、戦略を立てていく必要があります。
8.4. 製薬会社と患者への影響
これらの動きは、製薬会社と患者の双方に大きな影響を及ぼすことが予想されます。
製薬会社にとっては、特許戦略の根本的な見直しが必要になるでしょう。特に、デバイスや製剤に関する特許の取り扱いには細心の注意が必要になります。また、研究開発の優先順位にも影響が出るかもしれません。短期的には、法務コストの増加も避けられないでしょう。
患者への影響は、より複雑です。短期的には、ジェネリック医薬品の早期参入により、薬価の低下が期待できます。これは、多くの患者にとって朗報となるでしょう。
しかし、長期的な影響については意見が分かれています。薬価の低下は歓迎すべきことであるという認識がある一方で、それが新薬開発の遅延につながる可能性を懸念する声も上がっています。この問題をめぐっては、短期的な利益と長期的な医療の進歩のバランスをどう取るべきか、議論が続いています。
結局のところ、イノベーションと競争のバランスをどう取るかが鍵となります。政策立案者、規制当局、製薬会社、そして患者団体が協力して、最適な解決策を見出していく必要があるでしょう。
この問題の行方は、単に製薬業界の問題にとどまらず、医療システム全体の未来を左右する可能性を秘めています。今後の展開から目が離せません。
9. まとめ
FTCによるオレンジブック特許リストへの挑戦は、製薬業界に大きな転換点をもたらす可能性を秘めています。この取り組みは、ジェネリック医薬品の市場参入を促進し、医薬品価格の低下を目指す一方で、イノベーションと特許保護のバランスをどう取るかという難しい課題を提起しています。FDAの新ガイダンス、議会の動向、そして今後のFTCの執行措置の可能性など、多くの不確定要素が残されていますが、製薬会社は特許戦略の見直しを迫られ、患者は医薬品へのアクセス改善の恩恵を受ける可能性があります。この問題の行方は、単に製薬業界だけでなく、医療システム全体の未来を左右する重要な課題となっており、全てのステークホルダーが協力して最適な解決策を見出していくことが求められています。